脑缺血是一种常见的急性脑血管病,临床表现为突然发作的头晕、眼花、耳鸣,严重时出现单侧或双侧肢体无力、意识模糊、复视甚至双目失明[1-2]。海马是脑内对缺血较为敏感的部位之一,脑缺血会引起海马缺血损伤导致神经元功能障碍[3]。脑红蛋白(NGB)是一种在神经系统特异高表达的六配位血红素单体球蛋白,也是一种神经元损伤修复介质,可促进神经突起生长和分支,减轻神经元损伤[4]。相关研究发现,NGB能促进大鼠急性脊髓损伤后伤区轴突再生[5],然而其对大鼠脑缺血性神经损伤后受损神经元轴突生长能力的调控作用机制尚不明确。因此,本研究对大鼠脑缺血性神经损伤后NGB对受损神经元轴突再生能力的调控作用及机制进行探讨,以期为脑缺血性神经损伤的研究提供新思路。
材料与方法
1.材料:无特定病原体(SPF)级雄性SD大鼠30只,体质量(280±20)g,购自上海茂生衍生物科技有限公司,生产许可SCXK(沪)2017-0004。
2.方法
(1)分组及造模:将30只大鼠适应性喂养7 d后随机分为假手术组、模型组、Hemin组,每组10只。造模方法:采用双侧颈总动脉结扎的方法制备脑缺血模型。大鼠术前禁食12 h,腹腔注射0.3 mg/kg 10%水合氯醛(陕西圣瑞医药科技有限公司)麻醉后固定在手术台上,用毛剪剪短颈部正中被毛,碘伏消毒剪毛区,在其颈部做一长1.5~2.0 cm的正中切口,止血钳钝性分离皮下筋膜组织,暴露气管周围肌肉,在外科手术显微镜(武汉科尔达医疗科技有限公司)下找到左右两侧颈总动脉并分离结扎,消毒手术伤口周围皮肤后缝合皮肤切口,将大鼠置于鼠笼中待其苏醒,对大鼠进行神经功能评分,1~4分视为造模成功,剔除造模失败及死亡大鼠,并随机补充。假手术组大鼠仅暴露双侧颈总动脉但不穿线结扎。Hemin组大鼠于术后第1天腹腔注射50 mg/kg NGB诱导剂Hemin,每天1次。
(2)神经功能评定:2周后参照Zea-longa标准[5]对大鼠进行神经功能评定:不能自发行走且有意识障碍为4分;行走时向左侧倾倒为3分;行走时向左侧转圈为2分;不能完全伸展左侧前爪为1分;无神经功能缺损为0分。
(3)苏木素-伊红(HE)染色:神经功能评定结束后处死大鼠,取其脑组织,用10%甲醛溶液(上海谱振生物科技有限公司)固定,梯度酒精(南京森贝伽生物科技有限公司)脱水,二甲苯(深圳宏正兴科技有限公司)透明,石蜡包埋成块,用组织切片机(湖北孝感阔海医疗科技有限公司)5μm厚连续切片,脱蜡,脱水,苏木素(上海江莱生物科技有限公司)染色,流水冲洗,1%盐酸溶液(上海雅吉生物科技有限公司)分化数秒,流水冲洗,伊红(上海江莱生物科技有限公司)染色,脱水,透明,中性树胶(上海羽朵生物科技有限公司)封片,采用显微镜(苏州技高电子科技有限公司)观察HE染色结果。
(4)蛋白质免疫印迹法(Western blot):取各组大鼠脑组织,剪碎后置于玻璃匀浆器中,加入组织裂解液(北京天恩泽基因科技有限公司),匀浆,13 000 r/min离心15 min,取上清液,使用BCA试剂盒(上海荔达生物科技有限公司)测定蛋白浓度并进行定量,取总蛋白上样,电泳,切胶,转膜,5%脱脂奶粉封闭液(广州辉骏生物科技有限公司)封闭,加入1∶1 000稀释的兔抗生长相关蛋白-43(GAP-43)单克隆抗体(上海晅科生物科技有限公司)、1∶500稀释的鼠抗神经丝-200(NF-200)单克隆抗体(上海研生生化试剂有限公司)、1∶500稀释的兔抗NGB单克隆抗体(天津卡梅德生物科技有限公司)、1∶300稀释的兔抗磷脂酰肌醇3激酶(PI3K)单克隆抗体(杭州华安生物技术有限公司)、1∶200稀释的兔抗磷酸化蛋白激酶B(P-AKT)单克隆抗体(上海田源生物技术有限公司)、1∶500稀释的兔抗甘油三磷酸脱氢酶(GAPDH)单克隆抗体(杭州华安生物技术有限公司),4 ℃孵育过夜,芳香族共聚酯洗涤缓冲液(PBST)洗膜,加入1∶4 000稀释的山羊抗小鼠IgG(杭州纳晶科技有限公司),于37 ℃孵育60 min,PBST洗膜,将膜与超敏电化学发光(ECL)试剂的化学发光底物反应,暗室曝光、显影,将X光胶片用扫描仪(杭州梅清数码科技有限公司)扫描后使用美国Image J软件分析各条带灰度值,以GAPDH为内参蛋白,分析各目标蛋白表达量。
3.统计学处理:应用SPSS 22.0软件进行统计分析。计量资料以![]() 表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1.3组大鼠神经功能评分比较:模型组、Hemin组和假手术组大鼠神经功能评分分别(3.02±0.81)分、(2.11±0.48)分和0分,3组间比较差异有统计学意义(F=266.158,P<0.001)。Hemin组大鼠神经功能评分明显高于假手术组,且明显低于模型组(P<0.05)。
2.3组大鼠海马CA1区细胞形态学比较:假手术组大鼠海马CA1区锥体细胞形态正常,无核固缩现象,未见水肿,细胞分布比较均匀,胞体形态正常,其横截面呈圆形,胞浆染色均匀。模型组大鼠海马CA1区锥体细胞形态异常,出现明显核固缩现象,可见明显水肿,细胞分布散乱不均,胞体形态异常难以分辨,胞浆染色不均,尼氏小体淡染、数量减少,神经突触数量减少、消失,空泡细胞增多。Hemin组大鼠海马CA1区锥体细胞形态及分布趋于正常,胞浆染色较均匀,核固缩现象及水肿较模型组明显减少,尼氏小体深染、数量增多,神经突触数量增多,空泡细胞减少。见图1。

注:A:假手术组;B:模型组;C:Hemin组;白色箭头表示正常的锥体细胞,黑色箭头表示固缩的锥体细胞
图1 3组大鼠海马CA1区细胞形态学观察(HE染色,×400)
3.3组大鼠脑组织中NGB蛋白表达量比较:模型组、Hemin组大鼠脑组织中NGB蛋白表达量明显高于假手术组(P<0.05),且Hemin组明显高于模型组(P<0.05)。见图2、表1。
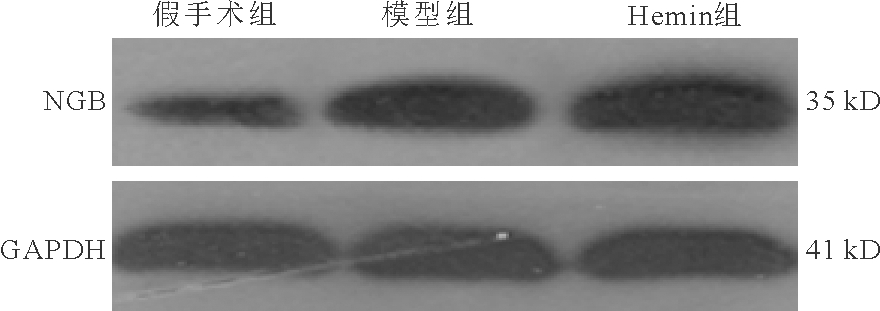
图2 3组大鼠脑组织中NGB蛋白表达
表1 3组大鼠脑组织中NGB蛋白表达量比较![]()

组别数量(只)NGB蛋白假手术组100.95±0.06模型组101.39±0.11aHemin组101.76±0.20abF值242.645P值<0.001
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05
4.3组大鼠脑组织中NF-200、GAP-43蛋白表达量比较:模型组、Hemin组大鼠脑组织中NF-200、GAP-43蛋白表达量明显高于假手术组(P<0.05),且Hemin组明显高于模型组(P<0.05)。见图3、表2。
表2 3组大鼠脑组织中NF-200、GAP-43蛋白表达量比较![]()
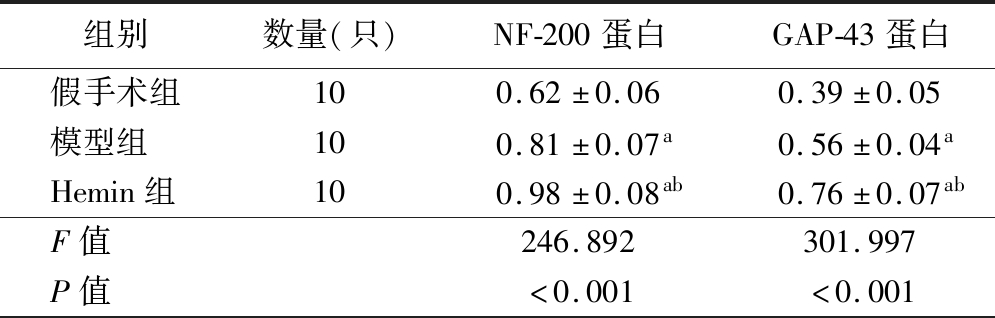
组别数量(只)NF-200蛋白GAP-43蛋白假手术组100.62±0.060.39±0.05模型组100.81±0.07a0.56±0.04aHemin组100.98±0.08ab0.76±0.07abF值246.892301.997P值<0.001<0.001
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05
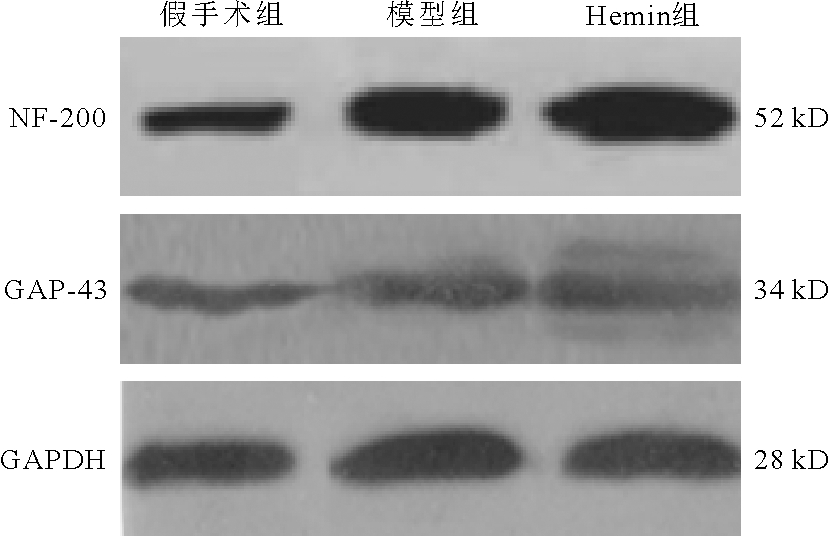
图3 3组大鼠脑组织中NF-200、GAP-43蛋白表达
5.3组大鼠脑组织中PI3K/AKT信号通路蛋白变化:模型组大鼠脑组织中PI3K、P-AKT蛋白表达量明显低于假手术组(P<0.05),Hemin组大鼠脑组织中PI3K、P-AKT蛋白表达量明显高于模型组(P<0.05),Hemin组明显低于假手术组(P<0.05)。见图4、表3。
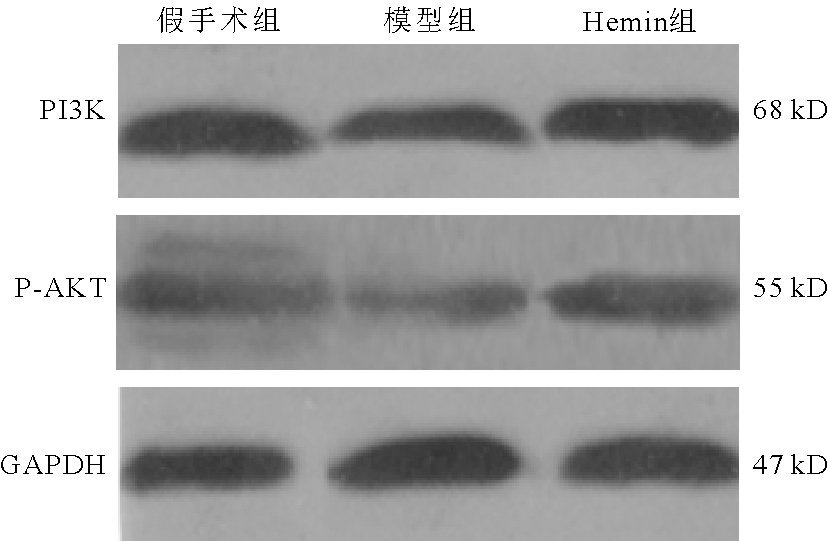
图4 3组大鼠脑组织中PI3K/AKT信号通路蛋白变化
表3 3组大鼠脑组织中PI3K/AKT信号通路蛋白变化![]()
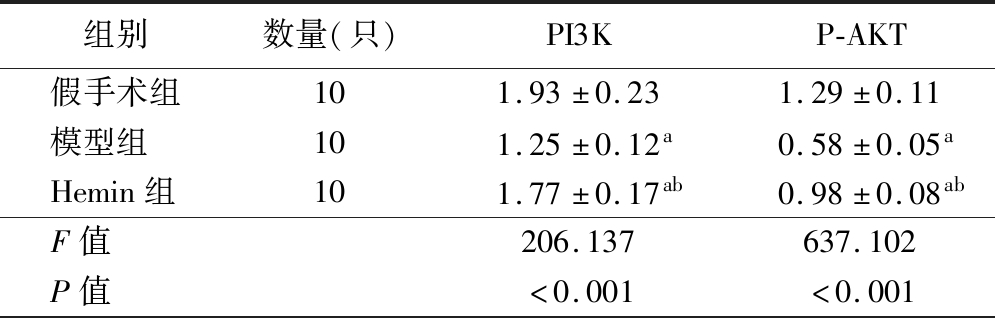
组别数量(只)PI3KP-AKT假手术组101.93±0.231.29±0.11模型组101.25±0.12a0.58±0.05aHemin组101.77±0.17ab0.98±0.08abF值206.137637.102P值<0.001<0.001
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05
讨 论
目前,关于脑缺血对海马神经元影响的研究很多。有研究发现,脑缺血可导致海马形态、结构及功能改变[6]。有研究结果显示,大鼠脑缺血后神经功能评分升高,脑梗死面积增加[7]。Che等[8]通过动物实验发现,大鼠在脑缺血15 min后可见海马CA1区的θ节律的振幅下降,且该区域锥体细胞形态异常,细胞骨架遭到破坏,神经突触密度降低,超微结构发生改变,出现明显水肿及核固缩现象。本研究结果与既往研究结果一致,提示大鼠脑缺血后易造成神经元损伤[7-8]。此外有文献报道,脑缺血还可引起海马内细胞因子改变,如NF-200、GAP-43等[9]。GAP-43是一种快速转运胞膜磷酸蛋白,由神经元胞体合成,在损伤后神经元胞体和出芽再生神经轴突中高度表达,参与快速轴索运输、神经轴突生长及修复[10]。NF-200是一种构成神经胞体及轴突骨骼框架的结构蛋白,在维持神经元细胞形态及轴突运输中具有重要作用,能较好地反映神经轴突损伤和修复情况,间接提示轴突再生状况[11]。脑缺血损伤发生后,NF-200在缺血损伤周边区神经轴突合成增加,以适应神经再生的需要[12]。因此,本研究将NF-200、GAP-43蛋白作为神经元轴突再生的标志性蛋白,结果显示模型组大鼠脑组织中NF-200、GAP-43蛋白表达量明显高于假手术组,说明脑缺血神经损伤后存在神经元轴突再生。
NGB是一种内源性神经保护分子,是血红素蛋白(HP)家族新成员,主要表达于代谢、耗氧剧烈的脊椎动物神经细胞中,在脑缺血缺氧、毒物损伤、氧化应激(OS)等病理情况下,NGB的表达均有不同程度的增加,其与氧具有高度亲和力,可通过协助氧转运、清除自由基、与细胞色素C(CYC)相互作用等多种途径增强组织对缺血性损伤的耐受,从而发挥对脑缺血损伤的保护作用[13]。Hemin即氯化高铁血红素,可诱导神经细胞NGB高表达,为NGB的诱导剂[14]。Tao等[15]通过体外培养神经细胞发现,NGB诱导剂Hemin浓度升高可减少神经元损伤。本研究结果显示,给予NGB诱导剂Hemin干预后,Hemin组大鼠的神经功能评分、大鼠海马CA1区细胞病理损伤程度较模型组明显下降,大鼠脑组织中NGB、NF-200、GAP-43蛋白表达量较模型组明显升高,说明NGB能够促进大鼠脑缺血性神经损伤后神经元大量合成NF-200、GAP-43,从而加速神经元轴突再生,促进神经组织损伤的修复。但目前NGB作为内源性神经保护因子改善神经功能的机制尚不清楚,有研究认为,大鼠脑缺血性损伤后NGB对受损神经元轴突再生的改善作用与PI3K/Akt信号通路有关[16],这与本研究结果一致。本研究结果显示,Hemin组大鼠脑组织中PI3K、P-AKT蛋白表达量明显高于模型组,其原因可能是PI3K导致了下游直接靶蛋白AKT的磷酸化,P-AKT进一步诱导下游效应分子的激活,导致细胞存活信号通路PI3K/AKT的激活,从而促进受损神经细胞再生。因此,本研究从分子水平进一步表明了PI3K/Akt信号通路可能介导了NGB对脑缺血性神经损伤的保护作用。
综上所述,NGB可能通过调控PI3K/AKT信号转导通路上调大鼠脑缺血性神经损伤后神经元生长相关蛋白NF-200、GAP-43表达,以促进受损神经元轴突再生,从而发挥对脑缺血性神经损伤的改善作用。
[1] 张欢欢,刘寒,何林,等.星形胶质细胞对脑缺血后神经元保护机制的研究进展[J].山东医药,2017,12(36):103-105.
[2] 王任翔,邱芬.川芎嗪对脑缺血大鼠梗死区周围纹状体增殖细胞分化的作用[J].中国药物应用与监测,2017,36(6):186-195.
[3] 彭熙炜.脑泰方对脑缺血/再灌注大鼠海马区Nrf2、HO-1和膜铁转运辅助蛋白表达的影响[J].中国药理学通报,2017,30(10):179-185.
[4] 张蓓,李亚军.脑红蛋白的神经保护作用及可能机制[J].国际神经病学神经外科学杂志,2017,71(8):234-239.
[5] 余化龙,何宁,刘志刚,等.骨髓间充质干细胞联合EPO对急性脊髓损伤大鼠神经运动功能的影响及机制探讨[J].山东医药,2016,56(18):37-39.
[6] Hu GQ,Du X,Li YJ,et al.Inhibition of cerebral ischemia/reperfusion injury-induced apoptosis:nicotiflorin and JAK2/STAT3 pathway[J].Neural Regen Res,2017,20(1):98-104.
[7] Wang J,Cao B,Han D,et al.Long Non-coding RNA H19 Induces Cerebral Ischemia Reperfusion Injury via Activation of Autophagy[J].Aging Dis,2017,8(1):71-84.
[8] Che N,Ma Y,Xin Y.Protective Role of Fucoidan in Cerebral Ischemia-Reperfusion Injury through Inhibition of MAPK Signaling Pathway[J].Biomol Ther (Seoul),2017,25(3):272-278.
[9] 刘斐雯,俞坤强,彭洪卫,等.电针百会、神庭穴对局灶性脑缺血再灌注大鼠学习记忆能力及海马区GAP-43蛋白表达的影响[J].中国中医急症,2016,25(2):189-192.
[10]窦思东,黄清豹,陈艳,等.DU20模拟振法对MCAO模型大鼠缺血区GAP-43表达的影响[J].长春中医药大学学报,2015,31(4):680-682.
[11]Ren L,Chang MJ,Zhang Z,et al.Quantitative Analysis of Mouse Dural Afferent Neurons Expressing TRPM8,VGLUT3,and NF200[J].Headach,2017,56(8):336-341.
[12]王维,吴江.慢性前脑缺血致血管性痴呆大鼠不同脑区NF200的经时变化研究[J].中风与神经疾病杂志,2015,32(3):201-204.
[13]Amri F,Ghouili I,Amri M,et al.Neuroglobin protects astroglial cells from hydrogen peroxide-induced oxidative stress and apoptotic cell death[J].J Neurochem,2016,140(1):98-102.
[14]Xie F,Xu R,Song X,et al.Joint protective effect of exogenous neuroglobin and hemin in rat focal ischemic brain tissues[J].Int J Clin Exp Med,2014,7(8):2009-2016.
[15]Tao Y,Ma Z,Liu B,et al.Hemin supports the survival of photoreceptors injured by N-Methyl-N-nitrosourea:the contributory role of neuroglobin in photoreceptor degeneration[J].Brain Res,2017,16(9):47-55.
[16]Zhang Q,An R,Tian X,et al.β-Caryophyllene Pretreatment Alleviates Focal Cerebral Ischemia-Reperfusion Injury by Activating PI3K/Akt Signaling Pathway[J].Neurochem Res,2017,42(5):1459-1469.
